KI-Systeme in der Medizin und deren praktische Anwendung in der Augenheilkunde

DOI: https://doi.org/10.54352/dozv.KFUY1418
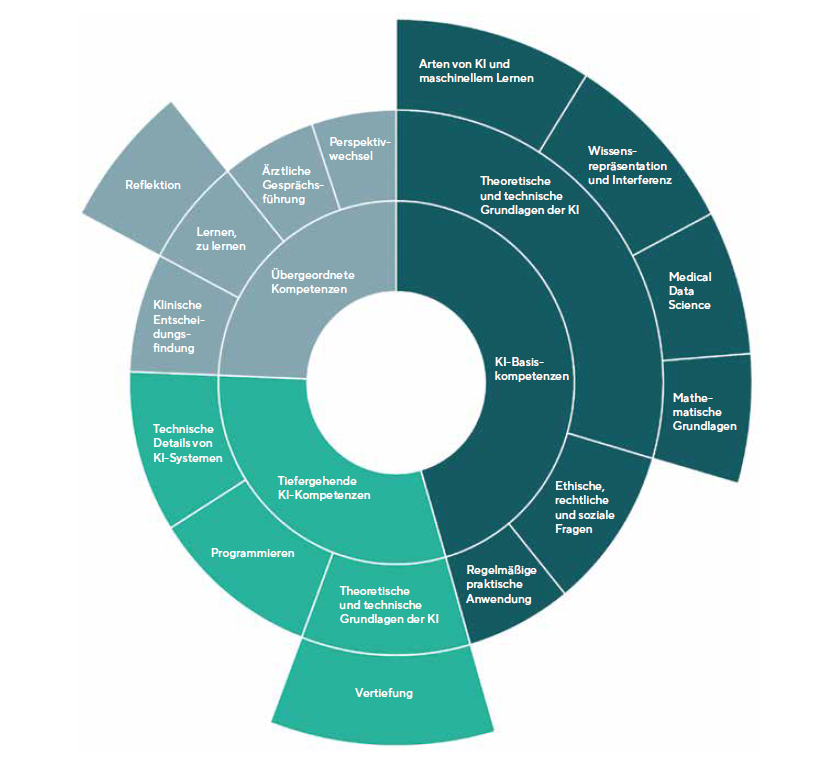
Integration der Künstlichen Intelligenz (KI) in den medizinischen Lehrplan deutscher Fakultäten
Durch die Erfolge von Deep Learning (DL) sind die Investitionen für Forschungen im Bereich der angewandten KI gestiegen. Auch für die Universitäten und Hochschulen spielt eine erfolgreiche und angemessene Integration von KI im Lehrplan eine immer größere Rolle. Dies zeigt auch das 2019 gestartete Projekt KI-Campus. Auf dem KI-Campus werden KI-Methoden in der Medizin vorgestellt und gezeigt, welche Krankheiten sich bisher mithilfe von KI am besten erkennen lassen. Der Umfang von über 100 angebotenen Kursen, Podcasts und Videos auf der Lernplattform zum Thema KI lässt erahnen, wie weit wir bereits in der Vernetzung der genutzten Systeme vorangeschritten sind und ebenso welchen Weg wir zukünftig in der Medizin gehen wollen. Der KI-Campus arbeitet in Kooperation mit Universitätskliniken und wird von Stiftungen, Instituten sowie dem Bundesministerium für Bildung gefördert. Die Charité – Universitätsmedizin Berlin, Institut für Medizinische Informatik hat gemeinsam mit dem KI-Campus die Studie „Die Lernplattform für Künstliche Intelligenz“ 1 veröffentlicht. Die Studie aus dem Jahr 2021 bezieht in einer Umfrage alle 39 Fakultäten, die Medizinstudierende gemäß der deutschen Approbationsordnung ausbilden, mit ein und führte eine Umfrage zum bestehenden sowie geplanten Lehrangebot in Bezug auf KI durch. Forschungsfragen waren unter anderem:
- Welche KI-bezogenen Kompetenzen sollten Mediziner*innen besitzen?
- Wie könnte ein bestmögliches Konzept zur Vermittlung von KI-Kompetenzen an Mediziner*innen aussehen?
- Was stellt die größten Probleme und Herausforderungen bei der Implementierung von Lernangeboten zum Thema KI in der medizinischen Aus-, Fort- und Weiterbildung dar?
Die Umfrage ergibt, dass 28 von 38 Einrichtungen Themen zu den Grundlagen der KI mit mindestens einer Lehrveranstaltung anbieten. Eine Mehrheit lehrt ebenso die Grundlagen des maschinellen Lernens (ML), jedoch sind die Kurse oft im Wahlpflichtbereich angesiedelt. 25 von 28 Einrichtungen gehen hier auf unterschiedliche Arten und Verfahren des ML ein und 24 von 28 decken oft komplexe Methoden wie neuronale Netze und bestärkendes Lernen ab. 23 Einrichtungen bieten folgende fünf von den Autoren vordefinierte Themengebiete der KI als Lernangebot an: Überblick von Anwendungsgebieten, praktische Anwendung, Kommunikation mit Patienten, rechtliche und soziale Fragen von KI-Anwendungen, Sonstiges. Bereits seit 2021 bieten 28 der 39 Fakultäten Inhalte mit KI-Bezug an. Fünf von ihnen gaben an, bereits vor 2017 ein Lehrangebot mit KI-Bezug zu unterrichten. 15 haben 2020 damit begonnen, dies im Lehrplan zu integrieren. Die rasant steigende Anzahl an Fakultäten, die KI aktiv im Lehrplan aufnehmen, lässt die Autoren schlussfolgern, dass eine steigende Dynamik in Bezug auf die Lehrinhalte begonnen hat. „Zur Analyse des Bedarfs an KI-Lernangeboten in der Medizin wurden Interviews mit 21 Expert*innen im Bereich KI und Medizin, Medizininformatik, Digitale Medizin bzw. Medizinische Aus-, Fort- und Weiterbildung geführt“.1 Laut der geführten Umfrage mit Mehrfachauswahl besteht der höchste Bedarf bei Lehrveranstaltungen mit den Schwerpunkten praktische Erfahrungen mit KI-Anwendungen sammeln (22), gefolgt vom Kennenlernen spezifischer Anwendungsfelder von KI (19), deren Implikation für das Arbeitsumfeld (Data Science; 19), Grundlagen der Kommunikation (18) sowie anwendungsspezifische Konzepte zu lehren (18).
Die Studie gibt überdies hinaus Auskunft über die Lehre mit KI-Bezug in der Medizin im Ausland, akkreditierte Fortbildung im Inland sowie Fellowship Programme, Masterstudiengänge mit KI-Bezug, Summerschools, Online-Fortbildungen und vieles mehr. Seit den 1990er Jahren gewinnt die Technologie, computergestützte Interpretationen medizinischer Bilder und Daten durchzuführen, stark an Dynamik. Die Analyse von Bilddaten reicht sogar bis in die 1960er Jahre zurück.2 Durch die Digitalisierung von medizinischen Aufnahmen, Entwicklung computergestützter Bildverarbeitungs-und Visualisierungstechniken können Bildinterpretationen schneller und zuverlässiger erfolgen. Durch DL ist es gelungen, dass die KI durch universelle Lernalgorithmen aus den eigenen Daten weiterlernt, die Leistung steigert und das Ergebnis optimiert, wodurch die Voraussetzung zur Nutzung von KI heutzutage so schnell voranschreitet, wie noch nie. Am 5. Oktober 2022 waren 178 Medizinprodukte, die KI und ML unterstützen von der FDA zugelassen. Darunter befinden sich sieben Gerätetypen für den Gebrauch in der Ophthalmologie, und zwei der Screening-Algorithmen werden für die Diabetische Retinopathie (DR) eingesetzt. Für das Training der KI-Systeme sind die Qualität und Quantität der verfügbaren Daten von größter Bedeutung, aber stellen momentan auch das größte Hindernis dar. Eine quantitative Bildanalyse nutzt die Extraktion quantifizierbarer Merkmale aus medizinischen Bildern zur Beurteilung des Vorhandenseins, der Schwere, des Veränderungsgrades oder des Status einer Krankheit, Verletzung oder eines chronischen Zustands im Vergleich zum normalen, gesunden Status.2
Die Genauigkeit der KI-Algorithmen bei DR und AMD
Bereits bestehende KI-Systeme werden weltweit angewendet. Lee et al. (2021)3 beschreiben in ihrer Studie den qualitativen und quantitativen Vergleich von sieben verschiedenen KI-Systemen, die als Screening für DR getestet wurden. Primär wurde die Sensitivität und Spezifität jedes Algorithmus im Vergleich zu einer Beurteilung durch einen Experten getestet. Entschieden werden sollte, ob der Patient auf der Grundlage der aufgenommenen DR-Screening-Bilder zu einer weiterführenden Untersuchung sollte oder nicht. Insgesamt wurden 311.604 Netzhautbilder von 26.436 diversen Patienten erfasst. Die Systeme wurden an zwei Datensatz-Gruppen getestet. Der Umfang der Ergebnisse der Sensitivität reichte von 50,98 bis 85,90 Prozent, die Spezifität von 60,42 bis 83,69 Prozent der negativen prädiktiven Werte von 82,72 bis 93,69 Prozent (negatives Testergebnis und tatsächlich keine DR) und der positiven prädiktiven Werte von 36,46 bis 50,80 Prozent (positives Testergebnis bei tatsächlich vorliegender DR). Ein hoher negativer prädiktiver Wert ist von besonderer Bedeutung, damit keine Patienten übersehen werden, die doch eine beginnende DR haben. Die Screening-Leistung der sieben Test-Algorithmen variierte sehr stark, auch innerhalb einer Testgruppe. Die menschlichen Experten haben zu 100 Prozent die DR erkannt. Nur ein Algorithmus hatte eine ähnliche Leistung wie die Expertengruppe bei der Sensitivität und Spezifität. Grund hierfür sieht die Studiengruppe in der fehlenden externen Validierung vor der klinischen Anwendung. In einer weiteren Studie werden in einem Review von Remon et al. (2021)4 15 Studien ausgewertet, die KI bei der Vorhersage von Altersbedingter Makuladegeneration (AMD) eingesetzt und geprüft haben. Die Studie gibt einen Überblick über aktuelle Anwendungen des ML als Teilgebiet der KI zur Vorhersage des medizinischen Status der AMD und die verschiedenen Methoden, Dateneingabearten und Bildgebungsmodalitäten zu beschreiben, die zur Identifizierung von Hochrisikopatienten verwendet werden.
Das Ziel der KI soll es sein, frühzeitig eine Diagnose stellen zu können, bevor die Prozesse starten, die zum fortschreitenden Sehverlust führen. Bisher basiert die angewendete KI bei der Diagnose von AMD auf ML und DL durch die Identifizierung von bildgebenden Biomarker, basierend auf Drusenmerkmalen und choriodaler Neovaskulationen (CNV) in Farbfundusfotos und optischer Kohärenztomographie (OCT) sowie die Identifizierung genetischer und soziodemografischer Faktoren, die für das Fortschreiten von AMD verantwortlich sind. Die Autoren sehen im Speziellen bei der Diagnose von AMD den Ansatz der KI, die nicht nach bisherigen Kriterien bei AMD screent, sondern so programmiert ist, dass sie nach Faktoren für eine geografische Atrophie (GA) sucht, um Risikopatienten zu identifizieren statt nach CNV. Durch diese Änderung des Algorithmus könnte die Wachstumsrate und -richtung von Biomarkern, insbesondere bei GA vorhersagbar werden.5,6 Dies hätte zur Folge, dass frühzeitig die GA-Entwicklung gehemmt wird, statt nur ein Fortschreiten der AMD zu bewirken. In der Studie zeigte sich, dass KI, die auf Basis von validen Daten trainiert wurde, gut funktionieren, jedoch nicht zwangsläufig korrekte Beurteilungsergebnisse bei der Testung externer Datensätze und klinischer Daten herausgeben. Bisher hat DL eine bessere Leistung als ML erbracht, sofern die Anzahl der Daten vergleichsweise größer ist und die Testanwendungsfälle in den Trainingsdaten gut dargestellt sind. ML funktioniert dann besser, wenn die Daten kleiner sind und konstruierte Merkmale besser mit subtilen Veränderungen der Krankheiten korrelieren.4 Der allgemeine Trend geht derzeit in Richtung hybrider Modellierung und der Verwendung von Multimodalität – Lernen an Datensätzen, die verschiedene Bildgebungsmodalitäten, Texte, Metadaten usw. aufweisen.
Schwäche der heutigen KI-Systeme ist die Basis der Datengrundlage
Unter den ausgewählten Studien für den Review von Remon et al. haben vier von 15 Studien die Basis ihrer KI auf externe Daten gestützt. Die Validierung anhand klinischer Daten aus der realen Welt bleibt auch bei Systemen zum AMD Screening, ebenso wie beim DR-Screening begrenzt. Ein großes Problem besteht in der Datenvalidierung. Ohne die Aufbereitung der erfassten Daten ist es schwierig, Algorithmen anzupassen.7 Auch die Bereitstellung ausreichender Datenmengen, die im Grad der Erkrankung sowie soziodemografischer Merkmale variieren, sind ausschlaggebend für eine KI, die bei verschiedenen Populationen angewendet werden soll. Die Vielfalt im Erscheinungsbild muss die KI erlernen und auf andere Bilder/Datengrundlagen übertragen können, um korrekt und valide zu entscheiden. Für eine erfolgreiche Implementierung von KI-Systemen, müssen erforderliche Infrastrukturen zur Entwicklung von Datenbanken aufgebaut werden, die auch die Möglichkeit bieten, die Daten über Gesundheitssysteme hinweg auszutauschen, um die Gültigkeit und Allgemeingültigkeit von KI-Anwendungen zu verbessern.8 Gerade bei Krankheiten, bei denen der Verlauf bei frühzeitiger Erkennung positiv beeinflusst werden kann, ist ein KI-System sinnvoll, sofern es eher als menschliche Kompetenzen es zulässt die Veränderung von Abnormitäten zum gesunden Auge zu erkennen. Eine hohe Sensitivität und Spezifität ist hierbei ausschlaggebend. Werden KI-Systeme mit Experten verglichen, so muss immer bedacht werden, dass nicht alle Patienten die Möglichkeit haben, ihren Zustand von einem Experten auf dem Gebiet der Augenheilkunde prüfen zu lassen.
Ausblick: KI im Myopie-Management
Eine derzeit laufende Studie in Singapur mit Li Lian Foo9 hat den Ansatz, KI im Bereich des Myopie-Managements einzusetzen. Da bereits in der Vergangenheit mit Hilfe von KI-Systemen Klassifizierungen von Krankheitsstadien genauer definiert werden konnten, will man versuchen, dies auch bei der Myopie anzuwenden. Das Potenzial der KI soll genutzt werden, um Myopie bereits im Anfangsstadium zu identifizieren und zu untersuchen, um dann frühzeitig eine effektive Therapie einleiten zu können. Foo sieht den Nutzen der KI in der Skalierbarkeit, Portabilität und Zuverlässigkeit, die diese Systeme bieten. Um gefährdete Kinder überhaupt frühzeitig herausfiltern zu können, arbeitet das Team um Foo an der Entwicklung eines Vorhersagealgorithmus. Ein möglichst großer klinischer Nutzen soll dadurch erreicht werden, dass Kinder zwischen sechs und zwölf Jahren als Zielgruppe definiert sind, denn in diesem Alter zeigt sich eine Progression am stärksten, aber die Kinder sind noch jung genug, um bei ihnen sinnvolle Therapien einzuleiten.10,11 Für die Programmierung wurden dem Algorithmus nur objektive Daten zur Verfügung gestellt, um subjektive Unterschiede ausschließen zu können. Damit die Notwendigkeit einer wiederholten Untersuchung vermieden wird, werden die objektiven Daten zu einem einzigen Zeitpunkt erhoben. Die KI soll also helfen, klinische Entscheidungen bereits nach der ersten Untersuchung ohne Folgeuntersuchung zu starten. So können unnötige Verzögerungen des Behandlungsbeginns für Risikopatienten vermieden werden.
Die vorläufige Leistung des KI-Algorithmus ist laut Foo und Team vielversprechend, basierend auf der Sensitivität und Spezifität. Darüber hinaus könnte es gelingen, dass der Algorithmus durch DL bereits Merkmale hoher Myopie in der Makula und der axialen Längenveränderung im Fundus von Hochrisikogruppen erkennt, ohne dass sie klinisch erkennbar sind. Die Verwendung eines Fundus-Basisbildes zur Identifizierung gefährdeter Schulkinder ist aufgrund der einfachen operativen Implementierung sehr vielversprechend. Mit dem Fortschritt in der digitalen Bildgebungstechnologie und der zunehmenden Verfügbarkeit dieser Geräte könnten Fundusbilder ein wertvolles klinisches Vorhersagewerkzeug sein. Durch frühzeitige Erkennung können gezielte und rechtzeitige Myopie-Kontrolltherapien eingeleitet werden, um das Risiko der Entwicklung einer hohen Myopie bei jungen Menschen und für kommende Generationen zu verringern. Im Zusammenhang mit KI in der Medizin muss anerkannt werden, dass die Entwicklungen angestrebt werden und darauf hinzielen, die geschätzte Anzahl an erkrankten Patienten in der immer älter werdenden und wachsenden Bevölkerung bewältigen zu können sowie Diagnosen frühzeitig zu stellen, damit bestehende Therapien bestmögliche Erfolge erzielen. KI-Systeme bieten ein enormes Potenzial, die Genauigkeit und Aktualität von Diagnosen sowie die Überwachung und Behandlung der Patienten zu optimieren.
Literaturverzeichnis
[1] Mosch et al. (2021). Lernangebote zu Künstlicher Intelligenz in der Medizin. Berlin: KI-Campus. www.ki-campus.org
[2] Morra, L., Delsanto, S., Correale, L. (2019). Artificial Intelligence in Medical Imaging: From Theory to Clinical Practice, 1st ed.; CRC Press, 2019.
[3] Lee, A. Y., Yanagihara, R. T., Lee, C. S., Blazes, M., Jung, H. C., Chee, Y. E., Gencarella, M. D., Gee, H., Maa, A. Y., Cockerham, G. C., Lynch, M., Boyko, E. J. (2021). Multicenter, Head-to-Head, Real-World Validation Study of Seven Automated Artificial Intelligence Diabetic Retinopathy Screening Systems. Diabetes Care, 44, 1168–1175.
[4] Romond, K., Alam, M., Kravets, S., de Sisternes, L., Leng, T., Lim, J. I., Rubin, D., Hallak, J. A. (2021). Imaging and Artificial Intelligence for Progression of Age-Related Macular Degeneration. Exp. Biol. Med., 246, 2159–2169.
[5] Pfau, M., Möller, P. T., Künzel, S. H., von der Emde, L., Lindner, M., Thiele, S., Dysli, C., Nadal, J., Schmid, M., Schmitz-Valckenberg, S., Holz, F. G.,Fleckenstein, M. (2020). Type 1 Choroidal Neovascularization Is Associated with Reduced Localized Progression of Atrophy in Age-Related Macular Degeneration. Ophthalmol. Retina, 4, 238–248.
[6] Niu, S., de Sisternes, L., Chen, Q., Rubin, D. L., Leng, T. (2016). Fully Automated Prediction of Geographic Atrophy Growth Using Quantitative Spectral-Domain Optical Coherence Tomography Biomarkers. Ophthalmology, 123, 1737–1750.
[7] Kim, D. W., Jang, H. Y., Kim, K. W., Shin, Y., Park, S. H. (2019). Design Characteristics of Studies Reporting the Performance of Artificial Intelligence Algorithms for Diagnostic Analysis of Medical Images: Results from Recently Published Papers. Korean J. Radiol., 20, 405.
[8] Niu, S., de Sisternes, L., Chen, Q., Rubin, D. L., Leng, T. (2016). Fully Automated Prediction of Geographic Atrophy Growth Using Quantitative Spectral-Domain Optical Coherence Tomography Biomarkers. Ophthalmology, 123, 1737–1750.
[9] Foo, L. L. (2022). Artificial Intelligence and Fundus Photography Can Predict High Myopia. Rev. Myopia Managing.,10, https://reviewofmm.com. Referencing: 3. November 2022.
[10] (2013). Myopia Stabilization and Associated Factors Among Participants in the Correction of Myopia Evaluation Trial (COMET). Investig. Opthalmology Vis. Sci., 54, 7871.
[11] Gifford, K. L., Richdale, K., Kang, P., Aller, T. A., Lam, C. S., Liu, Y. M., Michaud, L., Mulder, J., Orr, J. B., Rose, K. A., Saunders, K. J., Seidel, D., Tideman, J. W. L., Sankaridurg, P. (2019). IMI – Clinical Management Guidelines Report. Investig. Opthalmology Vis. Sci., 60, M184.
